간암 신약을 개발 중인 HLB가 또다시 미 식품의약국(FDA) 승인 보류란 쓴잔을 마셨다. 지난해 승인 보류의 원인이던 중국 항서제약의 화학·제조·품질관리(CMC) 이슈가 이번에도 발목을 잡았다. HLB는 FDA 승인 '삼수'에 나서겠단 계획을 밝혔지만, 문제는 시간이다.
미 식품의약국(FDA)이 HLB의 간암 신약 승인을 또다시 보류했다. 사진은 진양곤 HLB그룹 회장.[사진|뉴시스] |
"미 FDA 문턱 넘어도 첩첩산중, 주가 불붙은 HLB의 변수." 2024년 4월 우리가 항암 신약 '라보세라닙'의 미 식품의약국(FDA) 승인 이슈를 분석한 기사의 제목이다. 골자는 '라보세라닙'의 FDA 승인 기대감이 커지고 있지만 그만큼 불확실성도 높다는 거였다.
'라보세라닙'은 제약·바이오 업체 HLB가 개발 중인 신약이었는데, 당시 기사엔 수백개의 댓글이 달렸다. "어려운 상황에서 FDA 승인까지 신청한 기업을 칭찬은 못할망정 까내려는 게 기사냐?" "그냥 주가 공매도 세력과 결탁해 쓴 기사라는 느낌이 든다" "일부러 주가를 끌어내리려는 저의가 담긴 저격성 기사"란 비판적 댓글이 대부분이었다. 기사를 원색적으로 비난하는 댓글도 적지 않았다.
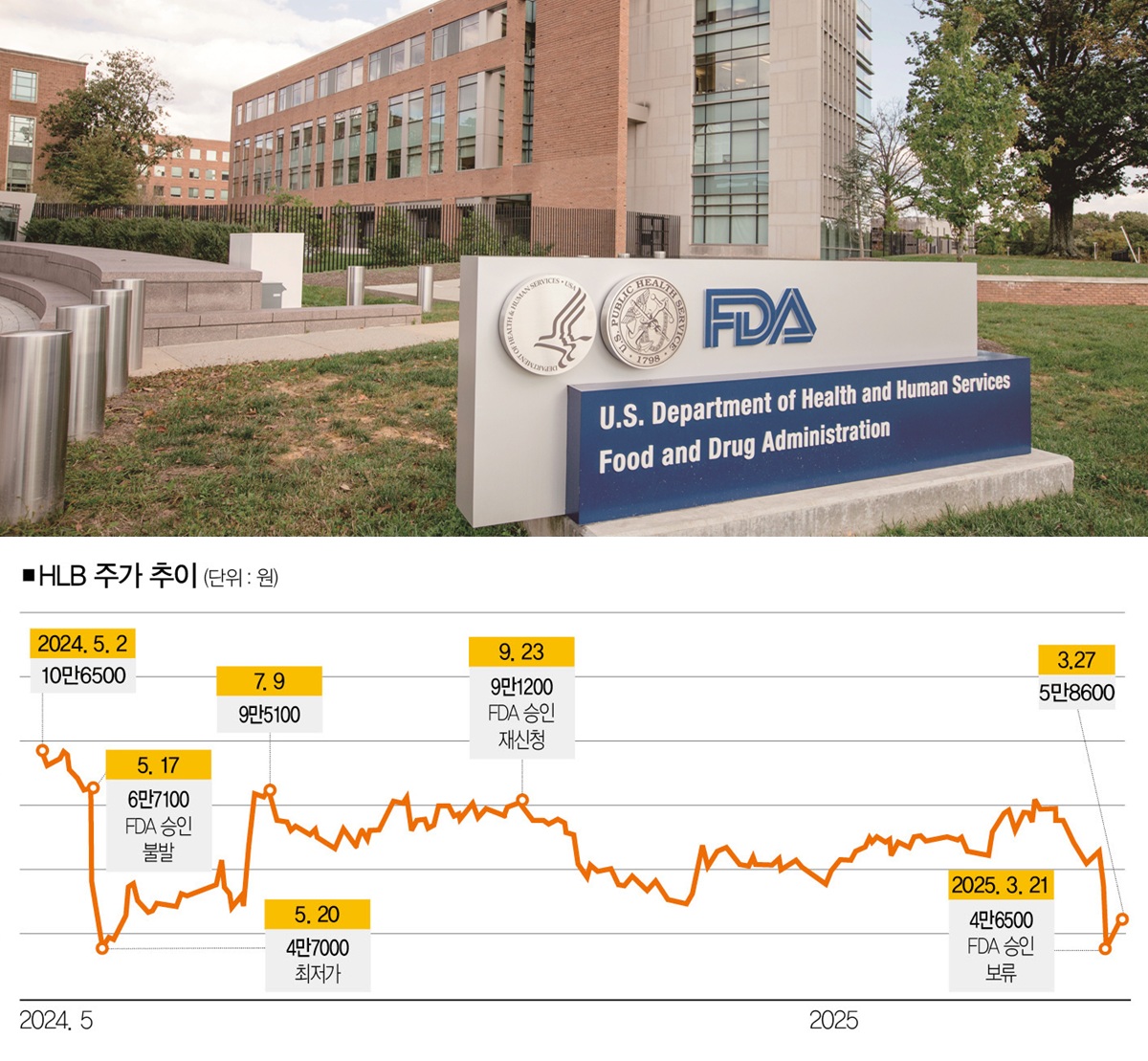
그 무렵, HLB그룹 관련주의 흐름을 보면 당연한 댓글이었을지 모른다. HLB그룹의 대장격인 HLB의 당시 주가를 복기해 보자. 지난해 1월 중순 4만3000원대였던 HLB의 주가는 2월 7만원대를 넘어 3월 26일 12만800원을 기록하며 사상 최고가를 경신했다. 그해 5월 FDA의 간암 1차 치료제(리보세라닙·캄렐리주맙 병용) 승인 여부를 앞두고 시장의 기대감이 높아진 결과였다.
HLB의 기대감도 컸다. HLB는 당시 "2023년 말 가진 FDA와의 중간 미팅에서 별 이슈 없이 논의를 진행했다"며 "FDA가 중국 항서제약의 캄렐리주맙 생산공장을 실사한 결과도 긍정적일 것으로 기대한다"고 밝혔다. HLB 측은 신약의 승인 결정을 앞둔 지난해 3월 이뤄진 파이널리뷰 미팅에서도 FDA가 허가에 영향을 미칠 만한 특별한 이슈를 제기하지 않았다고 강조했다.
하지만 HLB와 투자자의 기대와 달리 간암 신약은 FDA 승인을 받지 못했다. FDA가 HLB에 보낸 '보완요구서한(CRL·Complete Response Letter)'에는 다음과 같은 내용이 적혀 있었다. "신약에 사용한 항서제약의 약품 캄렐리주맙에서 일부 미비한 점을 발견했다. 여행 제한으로 BIMO(바이오리서치모니터링) 실사를 완료하지 못했다."
FDA가 항서제약에 지적한 건 화학·제조·품질관리(CMC) 문제였다. 러시아-우크라이나 전쟁의 영향으로 BIMO 실사를 마무리 짓지 못한 것도 악재로 작용했다.
HLB로선 신약의 유효성과 안전성을 지적한 내용이 없었다는 게 그나마 다행스러운 일이었지만, FDA의 문턱을 넘지 못한 상처는 컸다. "FDA의 승인을 받는 데 실패했다"는 소식이 알려지자마자 HLB그룹주는 가파른 하락세를 탔다. 그해 5월 16일 9만5800원이었던 HLB의 주가는 20일 4만7000원으로 반 토막 났고, 같은 기간 12조5335억원이었던 시가총액은 6조1497억원으로 쪼그라들었다.
[사진|연합뉴스] |
주가가 급락하자 HLB는 "FDA의 보완요구사항에 담긴 지적 사항을 개선해 재승인 절차를 밟겠다"고 밝혔다. 실제로 5개월 후인 그해 9월 HLB는 간암신약 허가를 위한 재심사 신청서를 제출하면서 자신감을 내비쳤다. "HLB는 보완요구사항의 원인이 된 항서제약 CMC를 꼬집는 지적사항은 어렵지 않게 보완할 수 있다. 신약 허가 가능성은 한층 더 높아졌다."
HLB의 적극적은 대처 덕분인지 HLB 신약의 FDA 승인을 기대하는 목소리가 커졌다. HLB그룹 계열사의 지분 매입에 나선 진양곤 HLB 회장의 행보도 기대감을 높였다. 진 회장이 지난해 11월부터 최근까지 HLB바이오스텝(40만여주), HLB이노베이션(26만여주), HLB제넥스(18만여주) 등 33억원어치가 넘는 지분을 매입했기 때문이다.
하지만 HLB의 신약은 지난 3월 20일 FDA의 승인을 얻는 데 또 실패했다. HLB는 3월 21일 FDA로부터 간암 1차 치료제의 '보완요구사항'을 수령했다고 밝혔다. 이번에도 발목을 잡은 건 중국 항서제약의 면역항암제 '캄렐리주맙' 공장의 CMC를 둘러싼 지적사항이었다.
진 회장은 "이번 보완요구사항의 이유 중 하나는 FDA가 지적한 항서제약의 CMC 문제가 충분히 해소되지 않았다는 것"이라면서 "항서제약이 FDA와 빠르게 접촉해 보완할 내용을 구체적으로 파악한 후 대응할 것"이라고 말했다.
그런데도 HLB그룹주는 빠르게 힘을 잃었다. 3월 21일 HLB를 포함해 HLB제약·HLB생명과학 3종목의 주가가 하한가를 기록했고, 나머지 6개 종목의 주가는 10% 넘게 떨어졌다.
다행히 HLB가 FDA 승인 '삼수' 의지를 밝히면서 주가 하락세에 제동이 걸리긴 했다. 진 회장은 유튜브 채널을 통해 "항서제약이 FDA에 요청하면 2~3주 내에 구체적인 미비점을 알 수 있다"며 "남은 지적사항은 지극히 경미하며, 충분히 극복할 수 있다고 본다"고 강조했다.
하지만 진 회장의 주장처럼 지적사항이 경미하더라도 적지 않은 시간이 걸릴 듯하다. HLB의 신약이 FDA 재승인을 받으려면 최소 2개월에서 6개월이 걸릴 전망이다. HLB의 방침이 '5월 재승인 신청'이란 점을 감안하면, 아무리 빨라도 7월, 늦어지면 11월에야 결과를 확인할 수 있다는 얘기다. HLB의 준비가 늦어지면 시간은 더 걸릴 수 있다.
문제는 투자자들이 '지루한 시간'을 기다릴 수 있느냐다. 무엇보다 국내외 투자환경이 좋지 않다. 투자자로선 오래 기다릴 처지가 아닐 수 있다. 국내 증시가 3월 공매도 재개를 앞두고 있다는 점도 변수다. 최근 상승세가 강했던 제약·바이오주 종목이 공매도 세력의 먹잇감으로 전락할 수 있어서다.
치열해질 글로벌 제약사와의 경쟁도 따져봐야 한다. 제약업계에 따르면 글로벌 제약사 브리스톨마이어스스큅(BMS)의 간암 1차 치료제(옵디보+여보이 병용요법)가 4월 FDA의 승인을 기다리고 있다.
BMS의 간암 치료제는 올해 1월 유럽의약품청(EMA)으로부터 1차 치료제로 승인을 받았는데, 그만큼 FDA 승인 가능성이 높다. HLB로선 달갑지 않은 소식이다. FDA 승인을 먼저 받는 경쟁자가 나올 수 있다는 의미기 때문이다.
제약업계 관계자는 "HLB그룹 중 흑자를 기록하고 있는 곳은 HLB제약 등 몇몇 계열사에 불과하다"며 "그런데도 HLB그룹의 주가가 상승세를 탄 건 실적보단 성장 가능성과 신약 기대감 때문으로 봐야 한다"고 말했다.
다행히 HLB의 주가는 최근 상승세로 돌아섰다. 3월 24일 15.48% 상승한 데 이어 25일에도 2.98% 올랐다. HLB가 FDA 재승인 신청에 나설 것이란 기대감이 주가에 긍정적인 영향을 미친 결과였다. 그렇다면 HLB의 주가는 '삼수(FDA 승인)'에 성공할 때까지 상승세를 유지할 수 있을까.
ksg@thescoop.co.kr <저작권자 copyright ⓒ 더스쿠프 무단전재 및 재배포 금지>