진양곤 HLB 회장. [HLB 유튜브 채널 갈무리] |
[헤럴드경제=최은지 기자] “곧 승인된다는 소문에 1억 넘게 투자했는데”
21일 여기저기서 또 ‘곡소리’가 퍼졌다. 희망고문도 이런 희망고문이 없다는 탄식이다. 이번엔 진짜 될 것이란 믿음에 거액을 투자한 이들이 수두룩하다.
그는 “이번만큼은 기쁜 소식을 전해줄 거라고 부풀었었는데 저희도 충격이 크지만, 주주 여러분들의 실망이 클 것 같다”며 “죄송스럽게 생각한다”고 밝혔다.
HLB의 ‘리보세라닙’과 중국 항서제약의 ‘캄렐리주맙’ 병용요법 신약 허가 신청(NDA)에 대해 FDA는 ‘승인’ 대신 ‘보완요청서(CRL)’를 건넸다. 지난해 5월에 이어 이번이 두 번째다.
진양곤 HLB그룹 회장이 2024년 리보세라닙-캄렐리주맙 병용요법 신약 허가 신청에 대해 첫번째 CRL을 받았을 당시 입장을 발표하는 모습. [HLB유튜브 갈무리] |
진 회장은 이날 새벽 직접 유튜브에서 CRL을 받았다는 사실을 전한 데 이어 같은 날 오전 9시에는 기자간담회를 열고 상세히 설명했다. 이번 FDA 승인을 기대했던 진 회장과 임원진은 당혹감이 역력했다.
FDA는 CRL 사유에 대해 “리보세라닙의 안전성과 약효는 SHR-1210(캄렐리주맙)과 병용을 통해 확인됐음으로, SHR-1210이 승인요건을 갖출 EO까지 리보세라닙의 승인을 보류한다”고 통보했다.
이에 대해 진 회장은 “캄넬리주맙의 규제 승인 조치가 이뤄져야만 리보세라닙도 병용으로 함께 승인될 수 있다는 뜻”이라며 리보세라닙의 문제가 아닌 캄넬리주맙의 문제라는 점을 강조했다.
미국 식품의약국(FDA). [로이터] |
지난 캄넬리주맙 CMC 실사에서는 3가지 지적사항이 있었는데, 첫 번째는 미생물 오염물 방지를 위한 멸균 시설이 충족되지 않는다는 것, 두 번째는 의약품 품질 보증을 위한 적절한 유관 검사 절차가 완전히 확립되지 않았다는 것, 세 번째가 컴퓨터 관련 시스템을 자동화하지 않거나 전자장비 정기 점검이 되지 않은 것이라고 설명했다.
HLB는 이 중에서 첫 번째 멸균 시설과 관련된 지적이 충족하지 않았다고 판단하고 있다. 진 회장은 “어떤 것이 FDA 기준을 충족하지 못했는지는 항서제약이 FDA로부터 문의해 답을 받아야 한다”며 “2~3주 내에 FDA의 답을 받으면 1개월 이내에 준비를 마치고, 그것이 ‘클래스1’(경미한 수정)이 되면 2개월 이내에 FDA가 결정하게 된다”고 밝혔다.
도널드 트럼프 미국 대통령 취임 이후 미중 갈등 상황이 FDA의 판단에 영향을 미친 것 아니냐는 질문에는 “캄넬리주맙은 2019년 판매 이후 중국의 블록버스터 신약이고, 이런 약물을 생산한 공장의 CMC 문제라면 미중 갈등이라고 생각할 수 있는데, 지난달까지 중국 바이오사가 개발하고 중국 공장에서 생산한 약물이 줄줄이 FDA의 승인을 받았다”고 선을 그었다. 준시바이오사이언스와 베이진의 PD-1 억제제가 FDA 승인을 받은 사례를 꼽았다.
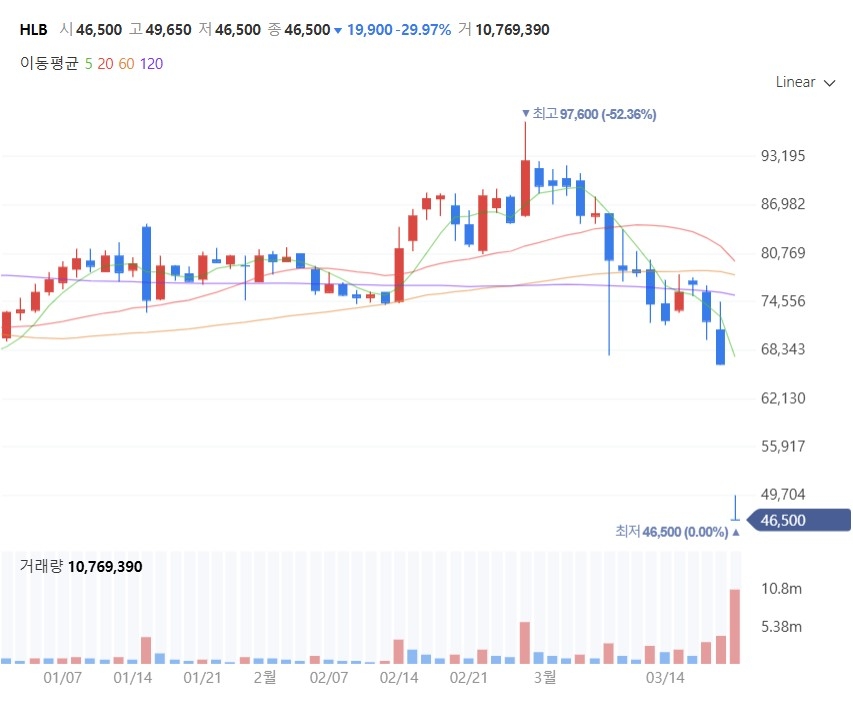
[네이버 증권 갈무리] |
진 회장의 구체적인 설명에도 주가 하락은 막지 못했다. 코스다 시가총액 4위 종목인 HLB는 오후 3시20분 현재 전일 대비 1만9900원(29.97%) 내린 4만6500원을 기록, 장 중 하한가를 보였다.
같은 시간 HLB생명과학(-29.94%), HLB제약(-29.92%), HLB글로벌(-18.51%) 등 그룹 상장 계열사도 줄줄이 하락세다.
진 회장은 리보세라닙 단독으로 승인을 추진하지 않고, 리보세라닙과 캄렐리주맙 병용 요법으로 삼수에 도전할 계획을 밝혔다.
그는 “CRL을 1차, 2차 받고 승인된 경우도 의외로 많아 빠른 시일 내 FDA의 재승인을 받을 수 있도록 하겠다”며 “이와 별개로 9월에 유럽의약품청(EMA)에 허가신청을 할 것”이라고 말했다.
진 회장은 오는 31일 정기주주총회에서 간담회를 통해 주주들에게 관련 사안을 직접 설명할 예정이다.